В настоящее время шерсть перерабатывают в текстильные материалы (пряжу,
сукна и др.) в основном в смесях с полиамидными и полиэфирными волокнами [1].
При производстве шерстяных сукон образуется большое количество невозвратных,
неутилизируемых отходов в виде выпадов, подмети, обора, пуха, горошка, сбоя
(сукновального, промывного и ворсовального). Эти отходы не нашли до сих пор
промышленного применения. Их количество обычно достигает 10% от массы исходного
сырья [2, 3].
Сжигание отходов шерсти как способ их уничтожения не практикуется в связи с
тем, что в дымовых газах, образующихся при горении шерсти, много трудноуловимых
дурнопахнущих сернистых соединений, диоксинов, копоти [4]. Синтетические
компоненты этих отходов (полиамидные и полиэфирные волокна) при горении
выделяют токсичные газы. Отходы шерстяных суконных фабрик вывозят на свалки
твердых бытовых отходов (ТБО). В частности, шерстяной суконный комбинат ОАО
“Невская мануфактура” (Санкт-Петербург) при полной загрузке производственных
мощностей ежегодно резервировал место на свалках ТБО для 100 т твердых
волокнистых отходов.
Складирование ТБО на полигонах требует отчуждения больших земельных площадей и
сопряжено с высокими транспортными затратами. При захоронении возникает
опасность ухудшения экологического состояния окружающей среды. В местах
складирования отходов создаются условия, способствующие возникновению пожаров
и распространению инфекций [5-7]. При наличии болезнетворной микрофлоры
шерстосодержащие отходы в составе ТБО могут стать биологически опасными [8].
 В последнее время разрабатываются экобиотехнологические методы переработки
твердых органических отходов и пластиков в полезные продукты [9].
Биотехнологические процессы относятся к экологически чистым и малоэнергоемким,
применяемые биоагенты весьма разнообразны и воспроизводимы в любых количествах. В последнее время разрабатываются экобиотехнологические методы переработки
твердых органических отходов и пластиков в полезные продукты [9].
Биотехнологические процессы относятся к экологически чистым и малоэнергоемким,
применяемые биоагенты весьма разнообразны и воспроизводимы в любых количествах.
В задачу настоящего исследования входило определение количества отходов на
разных стадиях технологического цикла при производстве тканых смесовых сукон
технического назначения, изучение их состава и свойств, выбор
биотехнологического метода утилизации c применением базидиальных грибов и
получение ферментных препаратов в виде фильтратов культуральных жидкостей,
содержащих пероксидазу и лакказу.
В табл.1 представлены усредненные показатели образования неутилизируемых
отходов при изготовлении шерстяных сукон, содержащих шерстяные (до 60%),
полиамидные и/или полиэфирные волокна (до 40%).
Неутилизируемые отходы образуются на всех стадиях изготовления технических
сукон, их количество достигает значительной величины, что определяет
необходимость поиска перспективных путей их применения.
В качестве биоагентов при переработке шерстосодержащих отходов используют
почвенную микрофлору, метаногенные бактерии и высшие грибы (табл.2).

Отходы утилизируют путем биодеградации, биоконверсии для получения
дополнительного источника энергии, удобрений, а также используют в качестве
субстрата для получения плодовых тел съедобных грибов, повышения урожайности
растений. Компостирование - длительный процесс, который сопровождается потерей
потенциально полезных для восстановления почвы питательных веществ, в том числе
азота [15]. Применение овечьей заводской шерсти для компостирования оправдано
лишь в случае невозможности использования ее для изготовления
валяльно-войлочных изделий, нетканых полотен [16] и для производства смесовых
пряж, включающих отходы коротковолокнистого льна и синтетические волокна [17].
Более полное использование “ресурсных качеств” [ 18] изученных отходов и
вовлечение их в производство ценных биохимических продуктов может быть
достигнуто путем использования биотехнологических процессов, основанных на
активности базидиомицетов (макромицетов).
Базидиомицеты играют важную роль в процессах биодеградации природных материалов
[19] и активно изучаются как продуценты оксидоредуктаз [20-24]. В работе были
использованы культуры базидиомицетов из Коллекции Ботанического института им.
В.Л. Комарова [25]: Trametes maxima (Montange) A. David et Rajchenbeig,
Coriolopsis caperata (Berkeley) Murrill (Coriolopsis fulvocinerea (Berkeley)
Murrill), Pholiota highlandensis (Peck) A.H. Smith et Hesler, Trametes hirsuta
(Wulfen:Fries) Pilat, Trametes ochracea (Persoon) Gilbertson et Ryvarden
(Coriolus zonatus (Nees: Fries) Quelet).
При выполнении исследований рассматривали два вида отходов:
- отходы 1, накапливающиеся в сборниках отходов прядильно-ткацкого производства;
- отходы 2, снимаемые с фильтров цеховых стоков производства технических сукон.
Образцы отходов собирали в течение 5 дней, а затем усредняли. Определяли
гигроскопические свойства отходов (кондиционную влажность и смачиваемость),
токсические свойства, компонентный состав (содержание волокнообразующих
полимеров, жиров и восков, зольных веществ) и элементный состав.
Определение кондиционной влажности образцов проводили согласно ГОСТ 10681 [26].
Смачиваемость дистиллированной водой определяли как время смачивания и полного
погружения образца массой 1 г.
Токсичность отходов оценивали методом биотестирования. Объектом биотестирования
являлись дафнии Daphnia magna. Для биотестирования использовали вытяжку,
полученную при настаивании 250г отходов в 1л водопроводной воды в течение
суток при 20°С. Водную вытяжку не фильтровали через бумажный фильтр. Среднее
количество дафний, выживших в водной вытяжке за определенное время,
характеризует острое токсическое действие отходов [27].
Содержание шерсти в отходах находили способом, разработанным для ее определения
в составе волокнистой смеси [28]. Предварительно высушенные до постоянной массы
образцы (2г) помещали в 200мл 0.5 н. раствора гипохлорита натрия на 15 мин,
затем раствор фильтровали. Нерастворившуюся часть образца промывали на сетке
холодной дистиллированной водой, нейтрализовали 0.2%-ным раствором уксусной
кислоты, снова промывали водой, после чего высушивали до постоянной массы и
взвешивали.
Содержание полиамида и полиэфира в отходах определяли согласно [28].
Нерастворившуюся в гипохлорите натрия часть образца промывали холодной
дистиллированной водой, после чего высушивали до постоянной массы и
взвешивали. Содержание полиамида и полиэфира определяли после полного
растворения полиамида в 85%-ном водном растворе муравьиной кислоты. Осадок
промывали муравьиной кислотой, дистиллированной водой, высушивали до постоянной
массы и взвешивали. Содержание полиамида и полиэфира рассчитывали с учетом
поправок на их частичное растворение в гипохлорите натрия и частичное
растворение полиэфира в муравьиной кислоте.
Содержание жиров и восков устанавливали путем их экстрагирования диэтиловым
эфиром в соответствии с ГОСТ 21008 [29].
Зольность определяли согласно методике [30] для образцов, предварительно
высушенных в течение 3 ч до постоянной массы. Навеску измельченного материала в
количестве 5 г помещали в фарфоровый тигель, предварительно доведенный до
постоянной массы, и обугливали в муфеле при температуре не выше 300°С, не
допуская воспламенения образца и потери золы. Затем тигель прокаливали при
750+50°С в течение 3ч. Охлаждение тигля проводили в эксикаторе над хлоридом
кальция. Содержание золы в волокнистом материале определяли по формуле
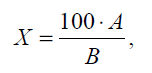
где А - масса абсолютно сухой золы, г; В - масса абсолютно сухой навески,
рассчитанная по результатам определения влажности, г.
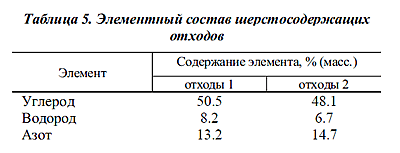
Данные о содержании углерода, кислорода и азота в рассматриваемом материале были
получены с помощью элементного анализатора “Hewlett-Packard”, модель 185.
Кондиционная влажность отходов 1 и 2 составила 11.7 и 14.9% соответственно.
Отходы хорошо смачиваются (1.0-1.5 мин) в воде и питательной среде,
приготовленной для культивирования базидиомицетов.
Результаты воздействия отходов 1 и 2 на биообъекты Daphnia magna оказались
идентичными (табл.3).

По данным биотестирования водных вытяжек отходы 1 и 2 можно отнести, согласно
[31], к отходам IV класса опасности для окружающей природной среды.
Компонентный состав отходов представлен в табл.4.
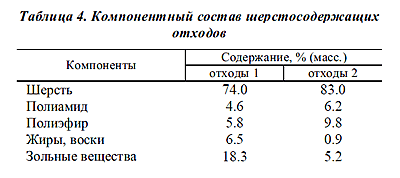 Соотношение содержания
шерсти и содержания синтетических волокон в отходах составляет 7 : 1 (отходы 1)
и 5 : 1 (отходы 2), т.е. отходы обогащены шерстяным компонентом по сравнению с
сырьевым балансом (1.5 : 1). Это объясняет высокое содержание азота в отходах
(табл.5). Соотношение содержания
шерсти и содержания синтетических волокон в отходах составляет 7 : 1 (отходы 1)
и 5 : 1 (отходы 2), т.е. отходы обогащены шерстяным компонентом по сравнению с
сырьевым балансом (1.5 : 1). Это объясняет высокое содержание азота в отходах
(табл.5).
 Выращивание базидиомицетов проводили поверхностным способом в конических колбах
вместимостью 500мл при температуре 24-26°С. Питательная среда содержала (в
г/л): глюкоза - 10, пептон - 3, КН2РО4 - 0.6, К2НРО4 - 0.4, MgSO4-7H2O - 0.5,
CuSO4 - 0.(45, FeSO4-7H2O - 0.005. Питательную среду и шерстосодержащие отходы
стерилизовали при давлении 1атм в течение 15мин. После стерилизации рН среды
устанавливался в пределах 5.6-5.8. В подготовленную среду вносили
шерстосодержащие отходы в количестве 10% от ее массы одновременно с засевом
культур базидиомицетов. Культивирование проводили в тёмной аэрируемой камере в
течение 3 0 сут. По окончании срока культивирования в культуральных фильтратах
определяли активность окислительных ферментов - пероксидазы и лакказы.
Активность пероксидазы и лакказы определяли с использованием в качестве
субстрата бензидина (в случае пероксидазы - в присутствии Н2О2)
фотоколориметрическим методом. Выращивание базидиомицетов проводили поверхностным способом в конических колбах
вместимостью 500мл при температуре 24-26°С. Питательная среда содержала (в
г/л): глюкоза - 10, пептон - 3, КН2РО4 - 0.6, К2НРО4 - 0.4, MgSO4-7H2O - 0.5,
CuSO4 - 0.(45, FeSO4-7H2O - 0.005. Питательную среду и шерстосодержащие отходы
стерилизовали при давлении 1атм в течение 15мин. После стерилизации рН среды
устанавливался в пределах 5.6-5.8. В подготовленную среду вносили
шерстосодержащие отходы в количестве 10% от ее массы одновременно с засевом
культур базидиомицетов. Культивирование проводили в тёмной аэрируемой камере в
течение 3 0 сут. По окончании срока культивирования в культуральных фильтратах
определяли активность окислительных ферментов - пероксидазы и лакказы.
Активность пероксидазы и лакказы определяли с использованием в качестве
субстрата бензидина (в случае пероксидазы - в присутствии Н2О2)
фотоколориметрическим методом.
В процессе культивирования всех видов базидиомицетов на питательной среде в
присутствии отходов рН среды устанавливалось близко к значениям рН в
контрольных опытах (табл.6), что оптимально для развития базидиомицетов.

Отобранные штаммы базидиомицетов за исключением Coriolopsis caperata в процессе
роста на средах успешно синтезируют ферментные препараты (табл.7). Культура
Coriolopsis сaperata отрицательно реагирует на введение в культуральную жидкость
исследуемых отходов и не может быть предложена для получения ферментных
препаратов.
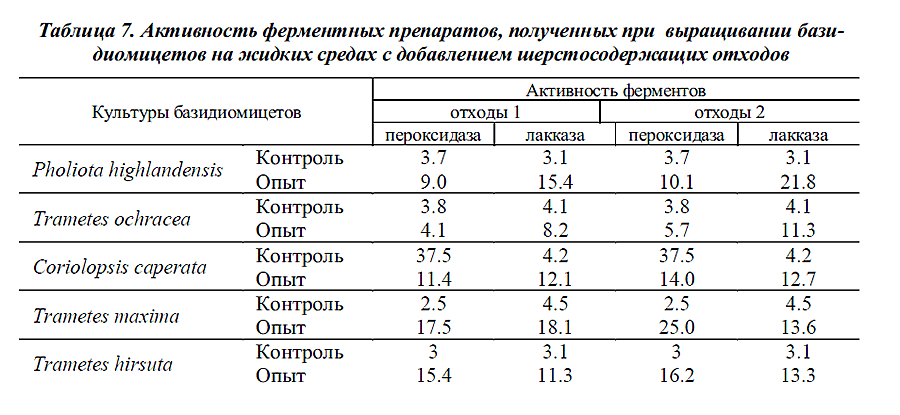
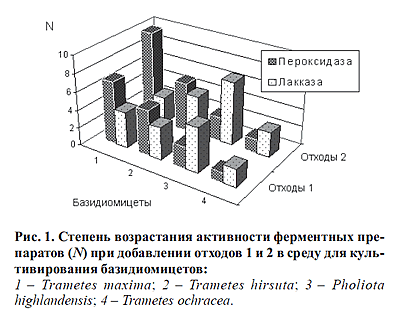 Активность окислительных ферментов, продуцируемых большинством базидиомицетов
на питательной среде на основе шерстосодержащих отходов, многократно
увеличивается по сравнению с контролем (см. рис.1). Активность окислительных ферментов, продуцируемых большинством базидиомицетов
на питательной среде на основе шерстосодержащих отходов, многократно
увеличивается по сравнению с контролем (см. рис.1).
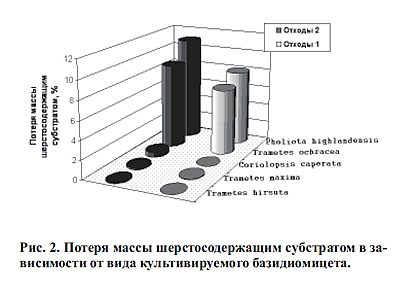 Наиболее активные
ферментные препараты можно получить с помощью культуры Trametes maxima, высокая
активность лакказы отмечается у Pholiota highlandensis. В процессе роста грибы
Pholiota highlandensis и Trametes ochracea синтезируют комплекс ферментов, обладающих способностью разрушать шерстосодержащие
твердые отходы (рис.2). Наиболее активные
ферментные препараты можно получить с помощью культуры Trametes maxima, высокая
активность лакказы отмечается у Pholiota highlandensis. В процессе роста грибы
Pholiota highlandensis и Trametes ochracea синтезируют комплекс ферментов, обладающих способностью разрушать шерстосодержащие
твердые отходы (рис.2).
Обнаруженное увеличение активности как пероксидазы, так и лакказы при
культивировании базидиомицетов Trametes maxima, Pholiota highlandensis,
Trametes hirsuta, Trametes ochracea в присутствии шерстосодержащих отходов
позволяет рассматривать эти биообъекты как весьма перспективные для получения
ферментных препаратов в виде фильтратов культуральных жидкостей, содержащих
пероксидазу и лакказу.
- Проведена количественная оценка невозвратных отходов, образующихся на разных
стадиях технологического процесса изготовления тканых сукон технического
назначения, содержащих шерсть и синтетические волокна (полиамид и полиэфир).
- Выполнен анализ компонентного и элементного состава шерстосодержащих отходов,
охарактеризованы их гигроскопические и токсические свойства.
- Показано, что на жидких питательных средах, включающих отходы
прядильно-ткацкого и отделочного производств, можно выращивать базидиомицеты Trametes maxima, Pholiota highlandensis, Trametes hirsuta, Trametes ochracea.
- Увеличение активности окислительных ферментов у базидиомицетов Trametes
maxima, Trametes hirsuta, Pholiota при культивировании в присутствии
шерстосодержащих отходов позволяет рассматривать эти грибы как перспективные
объекты для выращивания на исследуемых отходах.
- Окислительные ферменты, образующиеся в процессе выращивания базидиомицетов
на среде с шерстосодержащими отходами, могут представлять интерес для
практического использования.
|
