Полимерной основой природного шелка и паутины является склеропротеин фиброин,
макромолекулы которого состоят из 16 различных аминокислотных остатков и в
кристаллических участках полимера упорядочены в виде антипараллельных
β-складчатых листов [1-3]. Термодинамическая устойчивость кристаллической
структуры, стабилизированной межмолекулярными водородными связями, является
причиной плохой растворимости фиброина большинстве известных растворителей.
Между тем, фиброин может быть регенерирован из растворов в виде волокон, пленок
и мембран для разделения водно-спиртовых смесей [4], иммобилизации ферментов
[5], материала для контактных линз.
 Долгое время считалось, что фиброин можно растворить только в концентрированных
водных, органических или водно-органических растворах солей [6-10].
Концентрация полимера в этих растворах обычно невысока, чтобы можно было провести
необходимую для удаления соли процедуру диализа. Относительно недавно предложен
способ получения растворов фиброина с концентрацией, сопоставимой с таковой в
выделяемом секрете слюнных желез шелкопряда - до 30% (масс.). По этому способу
предварительно получают разбавленный раствор фиброина в водном растворе бромида
лития, и после диализа и регенерации фиброин становится растворим в
1,1,1,3,3,3-гексафтор-2-пропаноле [11]. При растворении фиброина в солевых
растворах разрушаются водородные связи в его упорядоченных
β-кристаллических
участках, макромолекулы становятся изолированными и приобретают конформацию
статистического клубка [12], поэтому активированный таким образом полимер легче
перевести в органический растворитель. Позже было обнаружено, что фиброин
растворим без активации в некоторых гидратных формах N-метилморфолин-N-оксида
(NMMO) [13] и ионных жидкостях [14]. Долгое время считалось, что фиброин можно растворить только в концентрированных
водных, органических или водно-органических растворах солей [6-10].
Концентрация полимера в этих растворах обычно невысока, чтобы можно было провести
необходимую для удаления соли процедуру диализа. Относительно недавно предложен
способ получения растворов фиброина с концентрацией, сопоставимой с таковой в
выделяемом секрете слюнных желез шелкопряда - до 30% (масс.). По этому способу
предварительно получают разбавленный раствор фиброина в водном растворе бромида
лития, и после диализа и регенерации фиброин становится растворим в
1,1,1,3,3,3-гексафтор-2-пропаноле [11]. При растворении фиброина в солевых
растворах разрушаются водородные связи в его упорядоченных
β-кристаллических
участках, макромолекулы становятся изолированными и приобретают конформацию
статистического клубка [12], поэтому активированный таким образом полимер легче
перевести в органический растворитель. Позже было обнаружено, что фиброин
растворим без активации в некоторых гидратных формах N-метилморфолин-N-оксида
(NMMO) [13] и ионных жидкостях [14].
 Для изучения механизма взаимодействия растворитель - растворяемое вещество
современная химия широко использует квантово-химические методы. Результаты
квантово-химических расчетов взаимодействия различных конформационных структур
фиброина с NMMO приведены в работе [15], с ионной жидкостью хлоридом 1-бутил-3-метилимидазолия - в работе [16]. Цель настоящей работы заключалась в получении
методом квантовой химии сведений о характере взаимодействия между молекулой
растворителя 1,1,1,3,3,3-гексафтор-2-пропанола и различными конформационными
моделями фиброина. В качестве моделей фиброина рассматривали
β-спиральную и
β-складчатую структуры фиброина, представленные шестью аминокислотными остатками
H[-Ser-Gly-Ala-Gly-Ala-Gly-]H, повторяющимися в упорядоченных участках
полимера. Различные модели пептидов, основанные на остатках глицина и аланина,
оценивались ранее [17, 18] на реалистичность в описании свойств полипептидов
полуэмпирическими (AM1 и РМ3) и ab initio методами. Для изучения механизма взаимодействия растворитель - растворяемое вещество
современная химия широко использует квантово-химические методы. Результаты
квантово-химических расчетов взаимодействия различных конформационных структур
фиброина с NMMO приведены в работе [15], с ионной жидкостью хлоридом 1-бутил-3-метилимидазолия - в работе [16]. Цель настоящей работы заключалась в получении
методом квантовой химии сведений о характере взаимодействия между молекулой
растворителя 1,1,1,3,3,3-гексафтор-2-пропанола и различными конформационными
моделями фиброина. В качестве моделей фиброина рассматривали
β-спиральную и
β-складчатую структуры фиброина, представленные шестью аминокислотными остатками
H[-Ser-Gly-Ala-Gly-Ala-Gly-]H, повторяющимися в упорядоченных участках
полимера. Различные модели пептидов, основанные на остатках глицина и аланина,
оценивались ранее [17, 18] на реалистичность в описании свойств полипептидов
полуэмпирическими (AM1 и РМ3) и ab initio методами.
Квантово-химические расчеты были проведены с помощью программного пакета HyperChem (Version 7.5) [19] в рамках полуэмпирического метода РМ3. Рассчитаны
оптимальные конфигурации и равновесные геометрические параметры моделей
β-спиральной и
β-складчатой структур фиброина и их комплексов с 1,1,1,3,3,3-гексафтор-2-пропанолом, построенных с помощью программы HyperChem 7.5.
Определены длина связей, валентные и торсионные углы, полная энергия и ее
изменение при образовании комплексов. Эффективные заряды на атомах рассчитывали
по Малликену.
Для изучения взаимодействия конформационных моделей макромолекул фиброина с
1,1,1,3,3,3-гексафтор-2-пропанолом в качестве начального приближения были
использованы координаты устойчивого комплекса 1,1,1,3,3,3-гексафтор-2-пропанол
- N-метилацетамид, поскольку для моделирования комплексов с полипептидами широко
привлекают результаты расчетов низкомолекулярных соединений с пептидными
группами СО-NH с аналогичным распределением углов и связей [20-24]. Равновесную
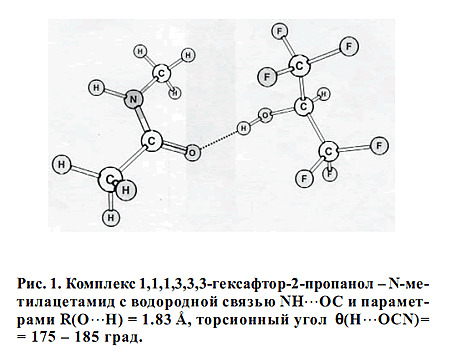
геометрию комплекса 1,1,1,3,3,3-гексафтор-2-пропанол - N-метилацетамид,
отвечающую минимуму на поверхности потенциальной энергии комплекса (рис.1),
рассчитали методом самосогласованного поля в приближении Хартри-Фока HF 6-31G* в
программном комплексе Gaussian-98 [25].
Свернутая в α-спираль модель фиброина имеет внутримолекулярные связи C=O---H-N,
для β-складчатой вытянутой конформации макромолекул характерно образование
межмолекулярных связей C=O---H-N, в которых группы СО и NH принадлежат разным
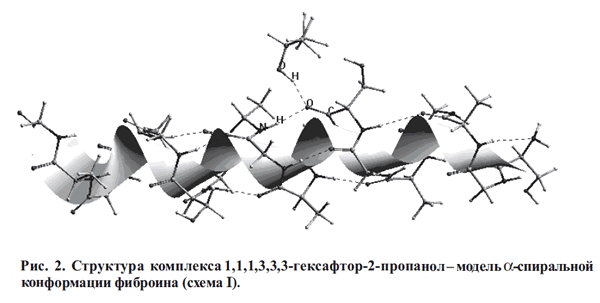
молекулам. На рис.2 приведена структура комплекса
1,1,1,3,3,3-гексафтор-2-пропанол - фрагмент спиральной структуры фиброина с
водородной связью между группой OH растворителя и группой C=O полипептида (схема
I).
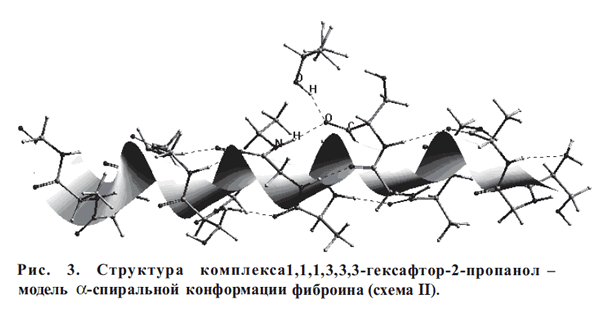
При взаимодействии 1,1,1,3,3,3 -гексафтор-2-пропанола с аминокислотным
остатком серина возможно образование одновременно двух водородных связей, в
которых участвует как атом водорода, так и атом кислорода группы OH
растворителя. Дополнительная Н-связь образуется между кислородом гидроксила
растворителя и водородом группы ОН остатка серина (схема II, рис.3).
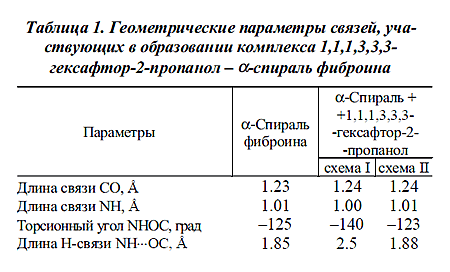
В табл. 1 приведены основные геометрические параметры модели фиброина в
а-спиральной конформации и их изменения при образовании сольватных комплексов с
молекулой 1,1,1,3,3,3-гексафтор-2-пропанола по схемам I и II.
 Взаимодействие модели фиброина с 1,1,1,3,3,3 -гексафтор-2-пропанолом вызывает
изменения торсионного угла пептидной группировки: группа СО разворачивается,
чтобы образовать связь с атомом водорода группы ОН растворителя, и при этом
удлиняется, сохраняя внутримолекулярную связь NH···OC. Наименьшие изменения
геометрии макромолекул имеют место при образовании комплекса растворителя с
аминокислотным остатком серина (схема II). Изменение энергии при образовании
комплексов, в зависимости от схемы, составляет -(20.8-21.7) кДж/моль. В
приведенных комплексах можно видеть, что взаимодействие Взаимодействие модели фиброина с 1,1,1,3,3,3 -гексафтор-2-пропанолом вызывает
изменения торсионного угла пептидной группировки: группа СО разворачивается,
чтобы образовать связь с атомом водорода группы ОН растворителя, и при этом
удлиняется, сохраняя внутримолекулярную связь NH···OC. Наименьшие изменения
геометрии макромолекул имеют место при образовании комплекса растворителя с
аминокислотным остатком серина (схема II). Изменение энергии при образовании
комплексов, в зависимости от схемы, составляет -(20.8-21.7) кДж/моль. В
приведенных комплексах можно видеть, что взаимодействие
1,1,1,3,3,3-гексафтор-2-пропанола с моделью фиброина не приводит к разрыву
внутримолекулярной связи C=0---H-N полипептида. При сольватации фиброина
увеличиваются по абсолютному значению положительный заряд атома углерода и
отрицательный заряд атома кислорода группы СО, участвующей в образовании Н-связи
с растворителем (табл.2). Этим можно объяснить стабилизирующую роль 1,1,1,3,3,3
-гексафтор-2-пропанола по отношению к α-спиральной конформации макромолекул
полипептидов.
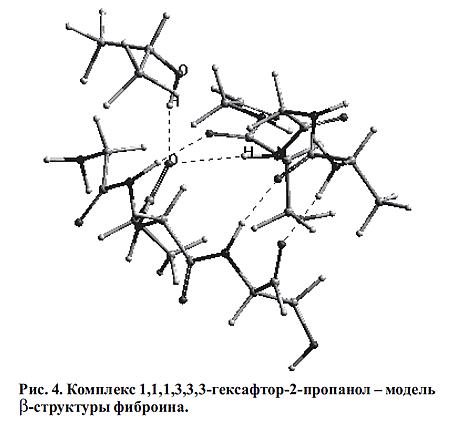
 Структура сольватного комплекса 1,1,1,3,3,3-гексафтор-2-пропанол - модель
P-структуры фиброина из двух связанных межмолекулярными Н-связями макромолекул
приведена на рис.4. Структура сольватного комплекса 1,1,1,3,3,3-гексафтор-2-пропанол - модель
P-структуры фиброина из двух связанных межмолекулярными Н-связями макромолекул
приведена на рис.4.
Изменение энергии при образовании комплекса значительно меньше по сравнению с
комплексом
1,1,1,3,3,3- гексафтор-2-пропанол - α-спираль, составляя -11.7 кДж/моль. Как и в
комплексе с α-спиралью, растворитель образует Н-связь с группой СО модели
фиброина, при этом сохраняются характерные для β-складчатой структуры фиброина
межмолекулярные водородные связи C=O---H-N. Изменения геометрических параметров
модели полипептида минимальны.
Таким образом, становится понятным отсутствие растворяющей
способности 1,1,1,3,3,3-гексафтор-2-пропанола по отношению к упорядоченной складчатой
форме фиброина. В раствор можно перевести макромолекулы только при условии
разрушения межмолекулярных связей, чего не происходит при взаимодействии с
растворителем β-складчатой структуры полипептида. В спиральной же структуре
полимера межмолекулярные Н-связи практически отсутствуют, а сохранение
внутримолекулярных связей не препятствует их переводу в раствор. Поляризация
внутри- и межмолекулярных связей в α-структуре фиброина при взаимодействии с
1,1,1,3,3,3 -гексафтор-2-пропанолом является причиной стабилизирующего действия
растворителя на а- спиральную структуру макромолекул.
- Полуэмпирическим квантово-химическим методом РМ3 проведен анализ параметров и
структуры сольватных комплексов моделей биополимера фиброина с органическим
растворителем 1,1,1,3,3,3-гексафтор-2-пропанолом.
- В качестве модели упорядоченных участков фиброина использован гексапептид H[-Ser-Gly-Ala-Gly-Ala-Gly-]H.
Исследования выполнены при поддержке Российского фонда фундаментальных
исследований (грант№ 06-08-00278).
|
Библиографический список
1. Trabbic K.A., YagerP. // Macromolecules. 1998. V.31. - P.462.
2. Valluzzi R., Gido S.P. // Biopolymers. 1997. V.42. - P.705.
3. Takanashi Y., GehohM., YuzurihaK. // J. Polymer Sci.: Polymer. Phys. 1991.
V.29. - P.889.
4. ChenX., Li W. e.a. // J. Appl. Polymer. Sci.1999. V.73. - P.975.
5. KuzuharaA., Asakura T. е.а. // J. Biotechnol. 1987. V.5. - P199.
6. Weimarn P.P. V. // Coll. Polymer Sci. 1926. V.40. - P.120.
7. Финкельштейн A.B., Птицын О.Б. Физика белка. - М.: МГУ. 2002. - 327 с.
8. Mathur A.B., Tonelli A. е.а. // Biopolymers. 1997. V.42. - P.61.
9. Matsumoto K., Uejima H. // J. Polymer Sci. Part A: Polymer Chem. 1997. V.35.
- P.1949.
10. Furuhata K.-L., Okada A. e.a. // J. Seric. Sci. Japan. 1994. V.63. - P.315.
11. Pat. 9315244 WO, IPC D 01 F 4/02. Fiber Spinnable Solutions of Silkform
Fibroin. R. Lock, 5.08.1993.
12. Magoshi J., Magoshi Y., Nakamura S. Silk polymers: material science and
biotechnology. - Washington: Am. Chem. Soc., 1994. - 421 p.
13. СашинаE.C., НовоселовН.П.,Хайнеманн К. // Жури. прикл. химии. 2003. Т.76. -
С.133.
14. Phillips D.M., Drummy L.F. e.a. // J. Am. Chem. Soc. 2004. № 126. - P.14350.
15. Сашина E.C., Новоселов Н.П. и dp. // Жури. общ. химии. 2008. Т.78. - С.139.
16. Сашина E.C., Новоселов Н.П. и dp. // Вестиик Саикт-Пе- тербургск. гос. уи-та
техиол. и дизайиа. 2007. Т.14. - С.122.
17. Elstner M., Jalkanen K.J. е.а. // Chem.Phys. 2001. V.263. - P.203.
18. Zhou P., Li G. е.а. // J. Phys. Chem. 2001. V.105. - P.12469.
19. Hyperchem Professional Refase 5.1 A Molecular Visualization and Simulation
Software Package Gainesville Hypercube, 1998.
20. Baker E.N., Hubbard R.E. // Prog. Biophys. Mol. Biol. 1984. V.44. - P.97.
21. Schellman J.A. // J. Phys. Chem. 1958. V.62. - P.1485.
22. Susi H. Structure and Stability of Biological Macromolecules. - New York: J.
Am. Chem. Soc. 1969. - 334 p.
23. KlotzI.M., Farnham S.B. // Biochemistry. 1968. V.7. - P3879.
24. Gill S.J., NollL. // J. Phys. Chem. 1972. V.76. - P.3065.
25. Frisch M. J., Trucks G. W. e.a. Gaussian 98. - Pittsburgh PA: Gaussian, Inc.,
1998.
|




 Долгое время считалось, что фиброин можно растворить только в концентрированных
водных, органических или водно-органических растворах солей [6-10].
Концентрация полимера в этих растворах обычно невысока, чтобы можно было провести
необходимую для удаления соли процедуру диализа. Относительно недавно предложен
способ получения растворов фиброина с концентрацией, сопоставимой с таковой в
выделяемом секрете слюнных желез шелкопряда - до 30% (масс.). По этому способу
предварительно получают разбавленный раствор фиброина в водном растворе бромида
лития, и после диализа и регенерации фиброин становится растворим в
1,1,1,3,3,3-гексафтор-2-пропаноле [11]. При растворении фиброина в солевых
растворах разрушаются водородные связи в его упорядоченных
β-кристаллических
участках, макромолекулы становятся изолированными и приобретают конформацию
статистического клубка [12], поэтому активированный таким образом полимер легче
перевести в органический растворитель. Позже было обнаружено, что фиброин
растворим без активации в некоторых гидратных формах N-метилморфолин-N-оксида
(NMMO) [13] и ионных жидкостях [14].
Долгое время считалось, что фиброин можно растворить только в концентрированных
водных, органических или водно-органических растворах солей [6-10].
Концентрация полимера в этих растворах обычно невысока, чтобы можно было провести
необходимую для удаления соли процедуру диализа. Относительно недавно предложен
способ получения растворов фиброина с концентрацией, сопоставимой с таковой в
выделяемом секрете слюнных желез шелкопряда - до 30% (масс.). По этому способу
предварительно получают разбавленный раствор фиброина в водном растворе бромида
лития, и после диализа и регенерации фиброин становится растворим в
1,1,1,3,3,3-гексафтор-2-пропаноле [11]. При растворении фиброина в солевых
растворах разрушаются водородные связи в его упорядоченных
β-кристаллических
участках, макромолекулы становятся изолированными и приобретают конформацию
статистического клубка [12], поэтому активированный таким образом полимер легче
перевести в органический растворитель. Позже было обнаружено, что фиброин
растворим без активации в некоторых гидратных формах N-метилморфолин-N-оксида
(NMMO) [13] и ионных жидкостях [14]. Для изучения механизма взаимодействия растворитель - растворяемое вещество
современная химия широко использует квантово-химические методы. Результаты
квантово-химических расчетов взаимодействия различных конформационных структур
фиброина с NMMO приведены в работе [15], с ионной жидкостью хлоридом 1-бутил-3-метилимидазолия - в работе [16]. Цель настоящей работы заключалась в получении
методом квантовой химии сведений о характере взаимодействия между молекулой
растворителя 1,1,1,3,3,3-гексафтор-2-пропанола и различными конформационными
моделями фиброина. В качестве моделей фиброина рассматривали
β-спиральную и
β-складчатую структуры фиброина, представленные шестью аминокислотными остатками
H[-Ser-Gly-Ala-Gly-Ala-Gly-]H, повторяющимися в упорядоченных участках
полимера. Различные модели пептидов, основанные на остатках глицина и аланина,
оценивались ранее [17, 18] на реалистичность в описании свойств полипептидов
полуэмпирическими (AM1 и РМ3) и ab initio методами.
Для изучения механизма взаимодействия растворитель - растворяемое вещество
современная химия широко использует квантово-химические методы. Результаты
квантово-химических расчетов взаимодействия различных конформационных структур
фиброина с NMMO приведены в работе [15], с ионной жидкостью хлоридом 1-бутил-3-метилимидазолия - в работе [16]. Цель настоящей работы заключалась в получении
методом квантовой химии сведений о характере взаимодействия между молекулой
растворителя 1,1,1,3,3,3-гексафтор-2-пропанола и различными конформационными
моделями фиброина. В качестве моделей фиброина рассматривали
β-спиральную и
β-складчатую структуры фиброина, представленные шестью аминокислотными остатками
H[-Ser-Gly-Ala-Gly-Ala-Gly-]H, повторяющимися в упорядоченных участках
полимера. Различные модели пептидов, основанные на остатках глицина и аланина,
оценивались ранее [17, 18] на реалистичность в описании свойств полипептидов
полуэмпирическими (AM1 и РМ3) и ab initio методами.

 Взаимодействие модели фиброина с 1,1,1,3,3,3 -гексафтор-2-пропанолом вызывает
изменения торсионного угла пептидной группировки: группа СО разворачивается,
чтобы образовать связь с атомом водорода группы ОН растворителя, и при этом
удлиняется, сохраняя внутримолекулярную связь NH···OC. Наименьшие изменения
геометрии макромолекул имеют место при образовании комплекса растворителя с
аминокислотным остатком серина (схема II). Изменение энергии при образовании
комплексов, в зависимости от схемы, составляет -(20.8-21.7) кДж/моль. В
приведенных комплексах можно видеть, что взаимодействие
Взаимодействие модели фиброина с 1,1,1,3,3,3 -гексафтор-2-пропанолом вызывает
изменения торсионного угла пептидной группировки: группа СО разворачивается,
чтобы образовать связь с атомом водорода группы ОН растворителя, и при этом
удлиняется, сохраняя внутримолекулярную связь NH···OC. Наименьшие изменения
геометрии макромолекул имеют место при образовании комплекса растворителя с
аминокислотным остатком серина (схема II). Изменение энергии при образовании
комплексов, в зависимости от схемы, составляет -(20.8-21.7) кДж/моль. В
приведенных комплексах можно видеть, что взаимодействие Структура сольватного комплекса 1,1,1,3,3,3-гексафтор-2-пропанол - модель
P-структуры фиброина из двух связанных межмолекулярными Н-связями макромолекул
приведена на рис.4.
Структура сольватного комплекса 1,1,1,3,3,3-гексафтор-2-пропанол - модель
P-структуры фиброина из двух связанных межмолекулярными Н-связями макромолекул
приведена на рис.4.