Основными функциями любого
хирургического шва является обеспечение
достаточно плотного, герметичного и надежного
соединения ушиваемых тканей и удержание их в
фиксированном положении с постоянной
компрессией в течение всех этапов заживления
раны, включая послеоперационный отек. Это
предопределяет особые требования к прочности и
эластичности шовных материалов, способности
надежно фиксироваться хирургическим узлом.
Вместе с тем шовный материал должен быть
биосовместимым, атравматично проходить через
ткани, не иметь капиллярности и фитильности,
сохранять свои свойства при стерилизации и в
процессе хранения [1-4].
После срастания краев раны функция
швов зачастую исчерпана и целесообразно
удаление из организма инородного материала
путем оперативного снятия швов либо, что
предпочтительнее, в результате биодеградации и
рассасывания хирургических нитей. Однако при
протезировании органов и тканей в
сердечно-сосудистой, пластической и других
областях хирургии швы должны гарантировать
надежное соединение синтетических протезов и
биологических тканей в течение очень
длительного периода, т.е. требуются
биорезистентные хирургические нити. В ряде
хирургических ситуаций целесообразно
применение антимикробных и других биологически
активных нитей.
Таким образом, периодически
обсуждаемая концепция создания единого
универсального шовного материала для любого
оперативного вмешательства принципиально
несостоятельна. Каждая конкретная операция
требует использования адекватного шовного
материала с учетом конкретной ситуации - общего
состояния больного, возраста, наличия инфекции,
воспалительного процесса и др. Поэтому одной из
проблем, определяющих дальнейший прогресс
современной медицины, является создание шовных
материалов, наиболее рациональных в той или иной
хирургической ситуации.
Следует отметить, что научная школа
кафедры технологии химических волокон и
проблемной лаборатории волокон специального
назначения, созданная заслуженными деятелями
науки и техники СССР профессорами А.И. Меосом и
Л.А. Вольфом, внесла серьезный вклад в создание
отечественных волокнистых материалов
медицинского назначения [5]. Так, впервые были
сформулированы научные принципы получения
биологически активных волокон и разработаны
первые антимикробные шовные материалы “биолан”
и “летилан” [6].
В дальнейшем эти исследования были
продолжены их учениками, и в результате получены
различные антимикробные хирургические нити,
среди которых наиболее известен “капрогент” [7],
а также обезболивающие, ферментсодержащие,
противоопухолевые, иммунодепрессантные,
радиоактивные и нити с другой собственной
биологической активностью, как индивидуальной,
так и сочетанной [8-15].
Наряду с разработкой биологически
активных шовных материалов проводились
исследования по получению широкого спектра
современных биологически инертных материалов:
мононитей, плетеных, псевдомононитей [16-20].
Для промышленной реализации этих
разработок в 1991 г в СПГУТД было создано
предприятие “Линтекс”, которое и осуществляет
серийный выпуск шовных материалов с
атравматическими иглами в стерильной упаковке.
Биологически инертные
хирургические нити
До середины XX века в мировой
хирургической практике в основном использовали
нерассасывающиеся нити из льна и хлопка, условно
рассасывающиеся шелковые нити, а также
рассасывающиеся - из подслизистого слоя овечьих
или серозной оболочки коровьих кишок (кетгут) [21].
Высокая реактогенность (особенно
кетгута и шелка из чужеродных для организма
белков, одновременно являющихся питательной
средой для микрофлоры), относительно небольшая
прочность в мокром состоянии, капиллярность и
фитильность обусловили активный поиск новых
шовных материалов. Особенно чувствительный удар
по кетгуту [22] нанесло в последнее время
эпидемическое заболевание BSE (вызывающее так
называемое “коровье бешенство”), в результате
чего в ряде стран он запрещен к использованию в
хирургии.
Нерассасывающиеся хирургические
нити
С развитием производства
синтетических волокон в 40-60 годах XX века в
хирургии стали использовать значительно более
биосовместимые полиамидные (ПА), полиэфирные (ПЭ)
и полипропиленовые (ПП) нити [21, 23]. Достаточно
долгое время волокна выбирались из ассортимента,
предназначенного для товаров массового
потребления или для технических целей без учета
степени чистоты полимеров и биологической
инертности, наличия в их составе катализаторов,
стабилизаторов, антиоксидантов и текстильных
вспомогательных веществ. Для удаления последних
применяли в основном стирки и промывки. В
дальнейшем, в особенности в последние годы с
переходом на новую систему производства и
контроля качества по стандарту GMP, шовные
материалы стали производить с высоким уровнем
чистоты на всех технологических переходах, что, в
свою очередь, существенно подняло их стоимость
[22].
Использование [3, 22] в качестве шовных
материалов высокомодульных (практически
нерастяжимых) параарамидных нитей кевлар, СВМ,
армос позволило за счет высокой прочности
уменьшить толщину шовного материала и тем самым
минимизировать массу имплантируемого полимера.
Однако отсутствие эластичности и уменьшение
диаметра нитей не удовлетворило хирургов из-за
сдавливания ушитых тканей на стадии
послеоперационного отека и, как следствие,
прорезания их швами или развития ишемии и
некроза. Кроме того, как показали наши
исследования (несмотря на диаметрально
противоположные результаты, представленные в
патенте [24]), нити СВМ быстро подвергаются
биодеструкции и образующиеся продукты вызывают
бурную реакцию тканей. На высокую скорость
биодеградации нитей на основе кевлара
указывается в работе [22].
Не пользуются большим спросом и
эластомерные материалы: мононити из
полиэфируретана - максилен (фирма “ Ergon Sutramed”) [21]
и эластик (фирма “Matsuda”) [21, 23] по причине
сложности мануального определения хирургом
степени натяжения высокоэластичной нити, а
соответственно и компрессии тканей, в процессе
наложения шва. Последние используют в основном
для мягкого стягивания тканей вокруг катетера,
введенного внутриартериально или
внутрисердечно. После удаления катетера нити
сжимают отверстие и препятствуют кровотечению.
Фактически по эластичности
рассмотренные нити занимают крайне
противоположные позиции. Принято считать [3], что
оптимальное относительное разрывное удлинение
хирургических нитей должно составлять 25±10%.
Прочностные свойства хирургических
нитей должны быть достаточными, чтобы обеспечить
надежное соединение ушиваемых тканей. Поскольку
для большинства нитей характерно снижение
прочности в узле ( для некоторых до 60%),
критическим моментом наложения шва является
затягивание узла хирургом. Поэтому фармакопея
США (USP) и Европейская фармакопея (ЕР) нормируют
для хирургических нитей именно прочность в узле.
Особенно существенно снижение прочности в узле у
мононитей.
Повышение прочности в узле возможно за
счет увеличения толщины нитей, но при этом
увеличивается масса шва, в том числе и масса
хирургического узла. Масса узла зависит также от
количества петель в нем, обеспечивающих
необходимую надежность шва, особенно при
повышении давления тканей в процессе
возникновения послеоперационного отека [21].
Более скользкие, например, комплексные
полиэфирные нити с низкофрикционным тефлоновым
(М-дек фирмы “Matsuda” и суполен фирмы “Resorba”) или
силиконовым (терилен фирмы “Ergon Sutramed”)
покрытиями требуют наложения нескольких
дополнительных петель [21]. Помимо увеличения
массы это связано с дополнительными затратами
времени при оперативном вмешательстве.
Считается, что полиэфирные плетеные
нити обладаютдостаточной прочностью, неплохой
надежностью узла и хорошей биосовместимостью. В
ассортименте практически всех известных
производителей шовных материалов имеются
плетеные полиэфирные нити: полиэстер фирмы
“Resorba”, дагрофил (“B. Braun”), дакрон (“Tyco- Davis and
Geck”), мерсилен (“Ethicon”), сургидак (“Tyco- Auto Suture”),
лавсан (“Линтекс”) и др. [21, 25].
Полиамидные плетеные нити аналогичны
полиэфирным по прочности, но уступают по
надежности узла и биологической инертности.
Поэтому плетеных полиамидных нитей (без
покрытия) за рубежом значительно меньше -
найролон (“Ethicon”) и бралон (“Tyco”) [21, 25].
Отечественные производители шовных материалов
(с учетом спроса у нашей хирургии на более
дешевые нити) выпускали в основном крученую
капроновую нить. В таком виде добавлялся еще один
недостаток - образование сукрутин из-за
неравновесности нитей. С учетом этого ООО
“Оптикум” (Москва) с 2006 г. начат выпуск плетеных
капроновых нитей.
В связи с постепенной ферментативной и
гидролитической деструкцией и потерей
прочности, а затем и массы полиамидные нити
принято относить к условно рассасывающимся [21].
Поэтому их нельзя применять при необходимости
неограниченного срока сохранения прочности
швов, в частности при протезировании. Вместе с
тем после заживления раны нецелесообразно
оставлять в организме полимерный материал на
длительное время, до полной его биодеградации, и
швы удаляют. Таким образом, нити,
классифицированные как условно рассасывающиеся,
на практике используются как нерассасывающиеся,
а их недостаточная биорезистентность
ограничивает области применения.
Аналогичная ситуация возникает при
использовании еще одного условно
рассасывающегося шовного материала из
натурального шелка. Очевидно, классификация
“условно рассасывающиеся” имеет настолько
условный характер, что применение ее практически
необоснованно, а с учетом того, что такие
материалы обычно подлежат удалению после
заживления раны, следует относить их к
нерассасывающимся. Предложено [3] считать
рассасывающимися нити, продукты деструкции
которых полностью выводятся из организма в
течение 12 месяцев.
Биодеструкции подвержены и
полиамидные мононити, хотя процесс, в котором
преобладает диффузионная составляющая,
протекает гораздо медленнее из-за их
сравнительно большого диаметра. Спектр
полиамидных хирургических мононитей
представлен на рынке достаточно широко: сутрон
(“Ergon Sutramed”), найлон (“Resorba”), дафилон (“B. Braun”),
дермалон и монософт (“Tyco”), этилон (“Ethicon”),
монамид (“Линтекс”) [21, 25]. Ограничения в
применении таких нитей связаны с их постепенной
биодеградацией. В основном они используются для
наложения съемных кожных швов, в нейро-, офтальмо-
и пластической хирургии.
Достоинства хирургических мононитей
заключаются в отсутствии пилящего эффекта при
проведении через ткани; фитильности и
капиллярности, сопряженных с опасностью
инфицирования шовного материала; врастания
тканей в нить, в результате чего снижается
болевой эффект при снятии швов. К их общим
недостаткам относятся повышенная жесткость,
меньшая прочность и надежность узла,
травмирование тканей острыми жесткими
кончиками, оставленными у узла, а также “
память” последней намотки, затрудняющая
манипуляции. Часть этих недостатков либо
нехарактерна для отдельных мононитей, либо может
быть в значительной степени устранена
различными технологическими приемами при их
получении. Так, полипропиленовые (ПП) мононити
обладают способностью фибриллироваться при
затягивании узла, что существенно повышает его
надежность [3, 4], а жесткость и “память” намотки
значительно снижаются при специальных
термообработках [12, 26] или при получении
мононитей из сополимеров или смесей
полипропилена с полиэтиленом [12, 27].
Биологическая инертность, достаточная
прочность, надежность хирургических узлов,
тромборезистентность, атравматичность,
отсутствие фитильности (и, как следствие,
устойчивость к инфицированию) делают
полипропиленовые мононити одними из наиболее
ценных хирургических материалов для самых
различных областей хирургии. Таким требованиям
отвечают мононити мопилен (“Resorba”), сургилен и
сургипро (“Tyco”), пролен (“Ethicon”), полипропилен
(“Sharpoint”), премилен (“B. Braun”), монофил
(“Линтекс”).
Еще выше биосовместимость, мягкость и
тромборезистентность при аналогичных
прочностных характеристиках и надежности узла у
поливинилиденфторидных мононитей (ПВДФ) [2]. Эти
нити - резопрен (“Resorba”), корален (“Ciba-Geigy Ergon
Sutramed”), марилон (“Catgut GmbH”), пронова (“Ethicon”),
унифлекс (“Линтекс”) - предназначены в большей
степени для сердечно-сосудистой и пластической
хирургии.
И все-таки указанные выше недостатки в той или
иной степени присущи всем мононитям.
В свою очередь, комплексные плетеные и
крученые нити также имеют недостатки. Наряду с
хорошими манипуляционными качествами они
обладают пилящим эффектом при проведении через
ткани, отличаются высокими капиллярными
свойствами и фитильностью.
Фитильный эффект комплексной нити
связан с проникновением и распространением
раневого экссудата по порам между волокнами.
Причем размер капиллярных пор между
элементарными волокнами в этих нитях,
составляющий обычно около 10 мкм, вполне
достаточен для проникновения внутрь нитей
бактерий, большинство которых имеет размер около
1 мкм. В нити они находят убежище от макрофагов и
нейтрофитильных гранулоцитов, размер которых
превышает 10 мкм. Наличие раневого экссудата,
являющегося питательной средой для микрофлоры, и
благоприятная температура создают условия для
инкубирования патогенных микроорганизмов [21], а
следовательно, для инфицирования сначала всего
шва (чему способствует фитильность нити), а затем
и окружающих тканей.
Для устранения недостатков
комплексных нитей и мононитей при сохранении
присущих им достоинств разрабатывались
многочисленные варианты так называемых
“псевдомононитей” [3, 4], т.е. комплексных нитей с
полимерным покрытием. В идеале покрытие должно,
не ухудшая биосовместимости, прочности и
манипуляционных свойств, устранять
капиллярность и фитиль- ность, придавать
атравматичность, повышать надежность
хирургического узла. Желательно за счет введения
в покрытие красителей обеспечивать нитям
контрастность на раневом фоне. Несмотря на то,
что многие зарубежные фирмы выпускают шовные
нити с различными покрытиями, получить
положительный эффект сразу по всем позициям не
удалось никому.
Так, плетеные полиэфирные нити с
силиконовым покрытием терилен (“Ciba-Geigy”) и
ти-крон (“Tyco”), а также с тефлоновым покрытием
суполен (“Resorba”) и полиэстер-S (“Catgut GmbH”)
недостаточно надежно держат узел. Так же ведет
себя капроновая нить сургилен (“Tyco”) с
силиконовым покрытием. Полиэтилентерефталатные
плетеные нити с покрытиями из полибутилата
(этибонд фирмы “Ethicon”) частично сохраняют
капиллярность и фитильность. Полиамидные нити с
монолитным полиамидным покрытием супрамид (“B.
Braun”, “Resorba”, “Tyco”), как показали наши испытания
[28], характеризуются сравнительно невысокой
фитильностью, повышенной надежностью узла, но на
порядок большей жесткостью по сравнению с
исходной нитью.
Нами разработаны и внедрены в серийное
производство на ООО “Линтекс” лавсановые
(фторэкс) и капроновые (фторлин) плетеные нити с
фторполимерным покрытием, обеспечивающим
нулевую фитильность, хорошую гибкость и
повышенную биосовместимость. Клинические
испытания показали, что эти нити удобны в
манипуляциях, надежно вяжутся хирургическими
узлами, атравматичны, не впитывают раневое
отделяемое и не инфицируются.
Подводя итог состоянию мирового рынка
нерассасывающихся шовных материалов, отметим,
что мононити доведены почти до совершенства, и
возможно лишь некоторое непринципиальное
улучшение тех или иных свойств. Плетеные нити
вполне удовлетворительны, особенно для
использования в тех случаях, когда нет
категорических требований к атравматичности и
асептике шовного материала. Полимерные покрытия
позволяют получать нити с улучшенными
потребительскими свойствами.
Рассасывающиеся хирургические
нити
К рассасывающимся (резорбирующимся,
абсорбирующимся) шовным материалам принято
относить нити, которые под действием
биологических сред подвергаются полной
деструкции в срок до одного года. При этом
скорость снижения прочности нити должна быть
соизмерима с темпами восстановления прочности
рубцовой ткани.
Лимитирующим процессом биодеструкции
может быть гидролиз полимера до
низкомолекулярных продуктов, способных
утилизироваться организмом или выводиться из
него. Преимущественно по такому механизму
происходит биодеструкция синтетических
рассасывающихся шовных материалов [3].
Энзиматическое рассасывание присуще в
большей степени нитям из природных полимеров -
кетгуту, коллагену, хитину, хитозану и альгинату,
которые деструк- тируются в основном под
действием ферментов [29].
Существует точка зрения [3], согласно
которой механизм разложения зависит в
значительной мере от особенностей структуры
полимера, кислотности среды в зоне имплантации
нити, температуры, вида соединяемых тканей,
солевого состава и других химических и
физиологических воздействий. Так, в определенных
условиях некоторые ферменты влияют на скорость
разложения типичных гидролизующихся полимеров -
полигликолевой кислоты и сополимера гликолевой
и молочной кислот. Поэтому, очевидно, нельзя
строго разделять эти процессы, можно лишь
выделять преобладающий.
Принято считать [3], что основным
преимуществом деструкции по гидролитическому
механизму является отсутствие “энзиматической
атаки”, вызывающей сенсибилизацию организма и
бурную реакцию подлежащих тканей. С учетом этого
фактора, а также невысокой прочности
коллагеновые, хитиновые, хитозановые и
альгинатные нити в настоящей статье
рассматривать не будем.
Следует отметить, что недостатком
гидролитически рассасывающихся нитей является
деструкция их в процессе изготовления и хранения
под действием влаги воздуха. С учетом этого их
перерабатывают в “сухих” помещениях (влажность
воздуха менее 10%) в течение короткого промежутка
времени, затем сушат в условиях глубокого
вакуума до остаточной влажности примерно 0.05% и
упаковывают в паронепроницаемые материалы. Это
существенно усложняет и удорожает
технологический процесс, однако позволяет
получать высококачественный рассасывающийся
шовный материал с длительным сроком хранения.
При имплантации шовной нити на первой
стадии происходит ее набухание, которое
начинается с поверхности и постепенно
захватывает более глубокие слои. Чаще всего
биодеструкция также начинается с поверхности,
причем у кристаллических полимеров вначале
затрагивает аморфные области [3, 30]. При этом
возникают “дефекты” структуры, раковины и
углубления. Продукты разрушения не остаются в
имплантате без изменения, а выводятся из него
благодаря жизнедеятельности окружающих тканей.
Пустоты, остающиеся на месте дефектов,
заполняются клеточной тканью. Одновременно в
организме активизируется деятельность
макрофагов и гигантских многоядерных клеток, при
этом выступающие части полимера обволакиваются
макрофагами, а за счет фагоцитоза происходит
транспортирование осколков материала и их
абсорбция или рассасывание.
Распад нитей происходит как за счет
химических и ферментативных процессов, так и в
результате проникновения тканей в пустоты и
трещины. Дальнейшее превращение биоразлагаемых
нитей (потеря прочности, фрагментация,
гомогенизация, полная резорбция макрофагами и
рубцевание шовных каналов) протекают замедленно
и для разных материалов могут оканчиваться в
сроки до 360 сут [30]. Чем быстрее происходит
гидролиз химических связей, тем благоприятнее
условия для образования соединительной капсулы
вокруг нити и тем тоньше эта капсула.
В тех случаях, когда полимер выделяет
токсичные продукты, привносит инфекцию в рану,
содержит иммунные факторы, ответная реакция
организма резко усиливается. Происходит
инфильтрация зоны имплантации
иммунокомпетентными клетками (нейтрофильными
гранулоцитами, моноцитами, лимфоцитами), что
приводит к повреждению прилежащих тканей. В этом
случае на этапе заживления наблюдается
разрастание соединительной ткани, расширяется
капсула вокруг нити и формируется грубый рубец
[3].
Таким образом, для рассасывающихся
нитей характеристиками первостепенной важности
являются сохранение прочности до формирования
надежного и герметичного рубца, а затем быстрое
удаление полимера и продуктов его биодеструкции
из организма. По исходным физико-механическим
характеристикам, структуре и манипуляционным
свойствам к рассасывающимся нитям предъявляются
такие же требования, как и к нерассасывающимся.
Синтетические рассасывающиеся нити (в
отличие от нерассасывающихся) предназначены
исключительно для изделий медицинского
назначения и в первую очередь для получения
шовных материалов. Вначале это были нити на
основе полимеров оксикарбоновых кислот - дексон
(фирмы “Davis and Geck”, 1968 г.) из полигликолида (ПГ) и
викрил (фирмы “Ethicon”, 1972 г.) из сополимера
гликолевой и молочной кислот в соотношении 9:1
(полилактин - ПГА 910).
Нить дексон имеет микрофибриллярную
структуру с периодическим чередованием
кристаллических (до 80%) и аморфных участков.
Сорбция воды, локализующейся вначале в аморфных
областях, при 37 °С происходит за несколько минут.
При введении в ПГ звеньев лактида
повышается гидрофобность полимера и снижается
его кристалличность [3]. Первое из этих явлений
приводит к снижению набухания и соответственно -
к небольшому увеличению срока сохранения
прочности (на 21-е сут сохранение прочности
дексона 35%, викрила - 40%). Одновременно уменьшение
кристалличности приводит к сближению сроков
потери прочности и полного распада (срок
рассасывания викрила 56-70 сут, дексона 60-90 сут).
Однако для практической хирургии эти отличия не
имеют принципиального значения, тем более что
реакция тканей на эти материалы очень похожа.
Считается [3], что варьированием
соотношения гликолида и лактида в сополимере
можно в достаточно широком диапазоне
регулировать сроки рассасывания.
Дексон и викрил имеют плетеную
структуру, так как из-за жесткости полимеров
невозможно получать мононити с хорошими
манипуляционными свойствами (мононити
производят только для микрохирургии и
офтальмологии диаметром 20-40 мкм). Для снижения
фитиль- ности и пилящего эффекта при прохождении
через ткани викрил имеет рассасывающееся
покрытие из поли- глактина 370 и стеарата кальция в
соотношении 1:1. С такой же целью на дексон наносят
покрытие из сополимера гликолида и капролактона
(дексон II).
Рассасывающиеся мононити сначала (1980
г.) получали из полидиоксанона - ПДС (PDS II, “Ethicon”),
модуль Юнга у которого в 4 раза ниже, чем у ПГ и
ПГЛ. Поведение этих нитей в организме похоже на
поведение дексона и викрила (есть даже мнение,
что воспалительная реакция на них ниже), а
скорость их распада меньше.
В дальнейшем было синтезировано
большое количество различных сополимеров и
получены комплексные и мононити, значительно
отличающиеся по срокам потери прочности, срокам
полного рассасывания, манипуляционным свойствам
и другим характеристикам.
В качестве сомономеров в различных сочетаниях и
соотношениях были использованы гликолевая и
молочная кислоты, диоксанон, капролактон,
триметиленкар- бонат. Варьировался и состав
полимерного покрытия (чаще всего использовали
полиглактин 370 или поликап- ролактон в смеси со
стеаратом кальция).
Тем не менее, весь широкий ассортимент
можно сгруппировать по срокам рассасывания -
быстро, средне- и длительно рассасывающиеся, а
также по структуре - плетеные и мононити.
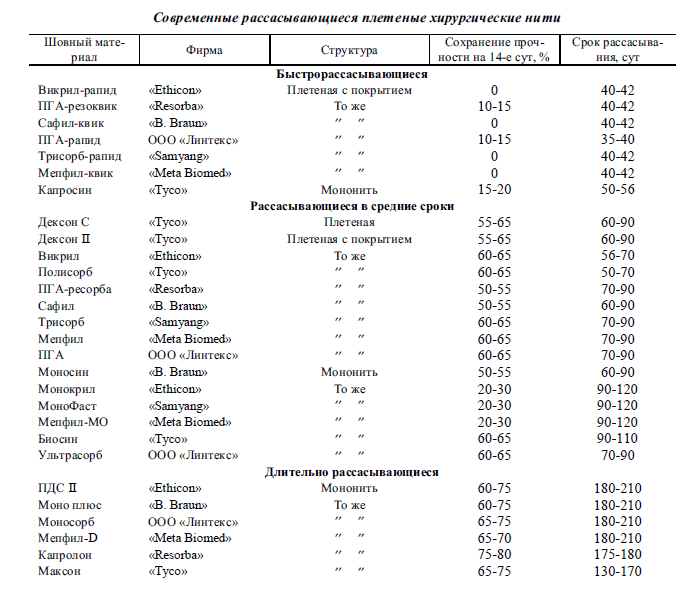
Свойства современных рассасывающихся шовных
материалов приведены в таблице. Представленные
материалы практически полностью удовлетворяют
требованиям современной хирургии.
Биологически активные
хирургические нити
По определению А.И. Меоса и Л.А. Вольфа,
к биологически активным относятся нити,
содержащие ингредиенты, которые либо постепенно
диффундируют из них и проявляют свое
химико-терапевтическое действие [5, 6], либо
остаются прочно связанными с полимером, а
биологическое действие осуществляют за счет
физического фактора, например радиоактивного
излучения [13-15, 31].
В зависимости от метода введения
биологически активные препараты могут входить в
тонкую структуру нити по типу соединений
включения, быть на ней зафиксированными
химическими связями либо закрепленными в виде
труднорастворимых индивидуальных веществ,
наносимых с помощью полимерных покрытий или
низкомолекулярных посредников. Способ
присоединения, предопределяющий прочность связи
нити с активным веществом, выбирается с учетом
особенностей проявления их биологического
действия.
Рынок биологически активных шовных
материалов представлен в основном
антимикробными, преимущественно разработанными
и производимыми в России: капрогент - капроновая
нить с фиксированным химической связью
гентамицином (ООО “Линтекс”, Санкт-Петербург),
никант - капроновая нить с полиамидным покрытием,
содержащим доксициклин (ВНИИСВ, Тверь), капроаг -
условно рассасывающаяся капроновая нить с
покрытием, наполненным хлоргексидина
биглюконатом (ООО “Репромед”, Москва).
В последние годы довольно успешно фирмой “Ethicon”
продвигается рассасывающаяся антимикробная
нить викрил плюс на основе полиглактина 910 с
триклозаном, хотя использование последнего в
качестве антимикробного компонента вызывает
определенное сомнение в связи с описанной в
литературе токсичностью хранении), а также
устойчивостью микрофлоры к этому антисептику,
давно и широко применяемому в товарах бытовой
химии.
В настоящее время микробиологи
установили [32, 33], что имплантированный материал
очень быстро колонизируется патогенной
микрофлорой по причине того, что все бактерии и
многоклеточные грибы при размножении образуют
сообщества, защищенные от окружающей среды
дополнительными оболочками - внеклеточными
мембранами, получившими название биопленки. Ряд
свойств сообществ и биопленок значим для клиники
и обеспечивает входящим в них бактериям
значительное увеличение выживаемости в
присутствии агрессивных веществ и антимикробных
препаратов. Результатом образования сообществ и
биопленок является выживание бактерий и грибов в
присутствии антибиотиков в количестве в 10-100 раз
большем, чем минимальная подавляющая
концентрация.
Микроорганизмы практически
недоступны и для факторов иммунной защиты как
клеток, так и антител. Использование
антибиотиков в обычных и даже повышенных дозах
оказывается малоэффективным или вообще
неэффективным, поскольку в крови не создаются
концентрации препаратов, способные справиться с
микроорганизмами, находящимися в составе
сообществ. С учетом этой ситуации целесообразно
оказать помощь собственным защитным силам
организма путем воздействия антимикробными
соединениями на находящиеся в биопленке
микроорганизмы изнутри - с поверхности шовного
материала [31, 34]. При этом антимикробным веществам
не приходится преодолевать внеклеточную
мембрану.
Появление антибиотико-резистентных
штаммов возбудителей хирургической инфекции
требует постоянной разработки новых поколений
антибактериальных средств и новых антимикробных
нитей. Такие нити должны обладать максимально
широким спектром действия на аэробную и
анаэробную микрофлору.
В качестве антимикробных средств нами
предложено использовать антибиотики -
гентамицин, клиндами- цин и метронидазол,
антисептики - диоксидин и мира- мистин, а также
некоторые соединения серебра. Объектами
модификации были полипропиленовые (ПП) плетеные
нити, поливинилиденфторидные (ПВДФ) мононити,
лавсановые (ПЭТФ) плетеные нити с фторполимерным
покрытием и рассасывающиеся плетеные нити на
основе полигликолевой кислоты (ПГА).
Широкие возможности с точки зрения
выбора антимикробных средств и регулирования
сроков биологического действия открывает
ионообменное взаимодействие препаратов с нитями
[31, 34].
Для придания ПП нитям ионообменных
свойств к ним предварительно прививали стирол в
присутствии динитрила азобисизомасляной
кислоты, а затем цепи полистирола сульфировали
серным ангидридом или хлорсульфоновой кислотой
в хлорированных углеводородах. С целью получения
антимикробных нитей проводили сорбцию
гентамицина [35], клиндамицина и метронидазола.
Обработку ПВДФ мононитей осуществляли
инклюдацией насыщенными растворами диоксидина в
полярных органических растворителях при 40°С, а
на лавсановые нити наносили фторполимерное
покрытие с ди- оксидином, миримастином и ацетатом
серебра.
Антимикробные свойства
полигликолидным нитям придавали путем нанесения
покрытия из сополимера гликолевой и молочной
кислот (70 и 30% соответственно), содержащего до 2%
мирамистина.
Результаты микробиологических и
предклинических испытаний полученных шовных
материалов показали, что для эффективного и
продолжительного антимикробного действия
необходимо ввести в нити не менее 3-5%
антибиотиков, 0.5% антисептиков и ацетата серебра.
Шовные материалы не обладают токсическими или
канцерогенными свойствами, не оказывают
негативного влияния на формирование
грануляционной ткани, а также на пролиферативные
потенции фибробластов.
Клиническое применение антимикробных
шовных материалов показало их эффективность для
профилактики гнойных осложнений после операций
у такой сложной категории пациентов, как больные
с онкологическими заболеваниями
желудочно-кишечного тракта.
С целью снижения доз обезболивающих
(зачастую наркотических) препаратов, применяемых
в послеоперационном периоде, разработаны
хирургические нити, обладающие антимикробным и
анестезирующим пролонгированным действием. В
качестве лекарственных ингредиентов в
ионообменные поликапроамидные (ПКА) нити с
привитой метакриловой кислотой и ПП нити,
получение которых описано выше, включали
ионогенные антибиотики: гентамицин, канамицин,
клинда- мицин и анестетики контактного действия:
новокаин, тримекаин, пиромекаин, лидокаин,
ультракаин. В результате получены ПП и ПКА
хирургические шовные материалы, содержащие до
10-15% антибиотиков и 10-12% анестетиков.
По данным исследований in vitro, исходная
антимикробная активность ПП и ПКА нитей на
твердой питательной среде проявлялась в зоне до
30-35 мм вокруг нитей, что перекрывает расстояние
между соседними швами на ране. Продолжительность
обезболивающего действия хирургических нитей
составляет 40-60 ч.
Для гидролитического расщепления
некротизированных тканей, всегда имеющихся в
зоне швов и являющихся питательной средой для
микроорганизмов, осуществляли иммобилизацию на
ионообменных ПКА и ПП хирургических нитях
протеолитических ферментов - трипсина и пепсина
[10, 11]. По активности ферменты, иммобилизированные
в количестве 6-10 мг/г нити, значительно
превосходят нативные.
Существенный интерес представляют ш
овные нити, способные одновременно подавлять
развитие микрофлоры и избирательно разрушать
некротизированные участки тканей. С этой целью
были разработаны методы получения шовных нитей,
сочетающих антимикробные и ферментативные
свойства. Установлено, что сорбция ферментов
описанными выше антимикробными материалами
практически не изменяет их антимикробную
активность, в то время как присутствие
антибиотиков сенсибилизирует протеолитическую
активность трипсина и пепсина [13].
Для локального химиотерапевтического
воздействия на злокачественные новообразования,
позволяющего снизить общетоксический эффект
противоопухолевых препаратов, к ионообменным
ПКА и ПП хирургическим нитям присоединяли до 35%
проспидина, 21% хинифура, 5.1% 5-фторурацила, 14%
циклофосфана, 16.9% сарколизина, 5% карминомицина и
7% рубомицина. В опытах in vitro установлено, что
наибольшими сроками действия в отношении
опухоли Эрлиха (30 сут) обладают ПП нити, а ПКА нити
полностью выделяют противоопухолевые
ингредиенты за 3-5 сут.
Принципиально новым типом
биологически активных хирургических
волокнистых материалов являются радиоактивные
нити, проявляющие свое действие посредством
испускания ионизирующего излучения
фиксированных в структуре нити радиоизотопов [36].
Радиоактивные нити могут быть
использованы для лучевой терапии
доброкачественных и злокачественных
новообразований поверхностной, внутриполостной
или внутритканевой локализации, в том числе
неоперабельных опухолей на жизненно важных
органах и тканях. При этом в отличие от широко
распространенной дистанционной лучевой терапии
щадящее лучевое облучение происходит в объеме
опухоли при минимальном повреждении подлежащих
тканей. Такие волокнистые материалы могут также
найти применение в качестве иммунологического
барьера для преодоления несовместимости
генетически чужеродных тканей и органов при
трансплантации. Расположенные по границе
реципиента и трансплантата, они будут оказывать
своим излучением длительное локальное
иммунодепрессивное воздействие и тем самым
подавлять реакцию отторжения.
Получение нити с собственной
радиационной активностью осуществляли путем
проведения химических реакций в цепях полимеров
с использованием радиоактивных реагентов,
содержащих применяемые в медицинской радиологии
изотопы: фосфор-32, серу-35 и церий- 144. Изотопы серы
обладают мягким 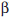 -излучением (0.167 МэВ), фосфора -
более жестким -излучением (0.167 МэВ), фосфора -
более жестким 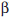 -излучением (1.711 МэВ), церия -
мягкими -излучением (1.711 МэВ), церия -
мягкими 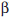 - и - и  -излучениями (0.304 и 0.134 МэВ
соответственно). Период полураспада составляет
для Р32 - 14.2 дня, S35 - 87.9 дня, Ce144 - 284
дня. -излучениями (0.304 и 0.134 МэВ
соответственно). Период полураспада составляет
для Р32 - 14.2 дня, S35 - 87.9 дня, Ce144 - 284
дня.
Фиксация радиоактивных изотопов на нитях
прочными ковалентными связями позволяет
получать стойкие в условиях эксплуатации
радиоактивные волокнистые излучатели высокой
мощности с разнообразными по природе и свойствам
излучением. Благодаря возможности использования
без дополнительного экранирования они смогут
найти применение в качестве источников
внутритканевой лучевой терапии, а также для
разработки новой аппликационной методики
лучевой терапии - внутренней аппликации.
Проводятся исследования по получению
радиоактивных шовных материалов с
комбинированной биологической активностью.
- Биологически инертные синтетические
нерассасывающиеся и рассасывающиеся нити п о
ассортименту и потребительским качествам
приблизились к пределу требований,
предъявляемых современной хирургией. Дальнейший
прогресс в этой области можно ожидать при
условии, что будут разработаны технологические
процессы получения прочных и эластичных нитей из
биосовместимых рассасывающихся п риродных
полимеров - полиоксиалканоатов (полиоксибутират,
полиоксивалерат и их сополимеры), коллагена,
хитина, хитозана, альгината и др.
- Внимание исследователей все больше
привлекают шовные материалы как с
индивидуальной, так и с комплексной
биологической активностью.
- Перспективно создание нитей, содержащих
нативные б иологические структуры (факторы роста
клеток, белки плазмы крови, клетки различных
органов и тканей и другие клетки, в том числе
повышающие биосовместимость), а также
саморегулируемых материалов, в структуре
которых имеются биологически активные молекулы,
способные заметно изменять свои свойства при
небольших физических или химических
воздействиях внешней среды.
|




