Ионные жидкости (ИЖ) представляют собой соли и состоят из
органического катиона и аниона. Примерами катионов могут служить имидазолий,
пиразолий, пиперидиний, пирролидиний; в качестве анионов используют
галогениды!, тиоцианат, C1-C6-карбоксилат, цианид, азид, тетрафторборат и др.
Интерес к ионным жидкостям в различных областях науки и технологии обусловлен
их высокой полярностью и электропроводностью [1-7]. Большие мольные объемы
катиона и аниона обусловливают тот факт, что температура плавления ИЖ не
превышает 100°C, в жидком фазовом со стоянии эти растворители находятся до
температуры выше 300°C. Высокими значениями энтальпии испарения и плотности
энергии когезии ИЖ [8] объясняются крайне низкие значения давления их
насыщенного пара. Большинство ИЖ термостабильны и негорючи [9].
Синтез этих соединений был разработан в 1980 г. в качестве альтернативы
экологически опасным летучим растворителям [6]. В 2001 г. в патентной
литературе появилось первое упоминание о возможности применения ряда ИЖ для
растворения целлюлозы [10]. Было установлено [11-13], что в ионных жидкостях,
синтезированных на основе имидазола, можно получить концентрированные растворы
целлюлозы со степенью полимеризации от 290 до 1200. Позднее ИЖ на основе
имидазола были опробованы для растворения других природных полимеров -
углеводов [14], фиброина шелка [15, 16], кератина шерсти [17]. Промышленностью
выпускаются ИЖ на основе имидазола с разными анионами и катионом общей формулы
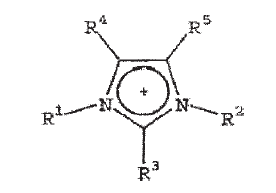
где R1 и R2 - алкильные группы C1-C6; R3 = Н или СН3; R4 = R5 = Н.
Влияние строения ИЖ на основе имидазола
на их растворяющую способность
 По литературным данным о растворимости целлюлозы, фиброина, кератина в ИЖ на
основе имидазола можно судить о том, что строение ионной жидкости имеет
решающее влияние на ее растворяющую способность. В работе [6] уточняется, что
растворы целлюлозы концентрацией 3% и выше могут быть получены в ионных
жидкостях, содержащих в качестве аниона хлорид (табл.1), причем в хлоридах
1-бутил-3-метилимидазолия и 1-аллил-3-метилимидазолия достигается концентрация
целлюлозы 10% и выше. По литературным данным о растворимости целлюлозы, фиброина, кератина в ИЖ на
основе имидазола можно судить о том, что строение ионной жидкости имеет
решающее влияние на ее растворяющую способность. В работе [6] уточняется, что
растворы целлюлозы концентрацией 3% и выше могут быть получены в ионных
жидкостях, содержащих в качестве аниона хлорид (табл.1), причем в хлоридах
1-бутил-3-метилимидазолия и 1-аллил-3-метилимидазолия достигается концентрация
целлюлозы 10% и выше.
Авторы работы [11] обнаружили, что в хлориде 1-бутил-3-метилимидазолия можно
растворить целлюлозы вдвое больше по массе, чем в его бромиде и тиоцианате. В
работе [18] сообщается о получении растворов целлюлозы в ацетате
1-бутил-3-метилимидазолия.
Растворимость в ИЖ полипептидов также зависит от вида катиона. В работе [15]
показано, что фиброин шелка растворим в хлориде 1-бутил-3-метилимидазолия, но
при замене аниона на Br-, I-, BF4-,
AlCl4- растворяющая способность ИЖ
пропадает. При сравнении растворимости кератина шерсти в ионных жидкостях на
основе 1-бутил- 3-метилимидазолия сделаны выводы, что хлорсодержащий
растворитель имеет более высокую растворяющую способность по отношению к этому
полипептиду, чем его бромид; при анионах BF4- и PF6- названная жидкость
растворителем кератина не является [17].
 Таким образом, согласно литературным данным, хлорид 1-бутил-3-метилимидазолия
обладает более высокой растворяющей способностью по отношению к природным
полимерам целлюлозе, фиброину и кератину в сравнении с ионными жидкостями с тем
же катионом, но в качестве аниона содержащими Br-, I-, SCN-, BF4-, PF6-,
AlCl4-. Нами проведено сравнительное исследование растворимости некоторых
природных и синтетических полимеров в 1-бутил-3-метилимидазолия хлориде и
ацетате (соответственно БМИХ и БМИА). В табл.2 приведены значения максимально
достигнутых при температуре растворения 90°C концентраций растворов полимеров
в этих ИЖ. Таким образом, согласно литературным данным, хлорид 1-бутил-3-метилимидазолия
обладает более высокой растворяющей способностью по отношению к природным
полимерам целлюлозе, фиброину и кератину в сравнении с ионными жидкостями с тем
же катионом, но в качестве аниона содержащими Br-, I-, SCN-, BF4-, PF6-,
AlCl4-. Нами проведено сравнительное исследование растворимости некоторых
природных и синтетических полимеров в 1-бутил-3-метилимидазолия хлориде и
ацетате (соответственно БМИХ и БМИА). В табл.2 приведены значения максимально
достигнутых при температуре растворения 90°C концентраций растворов полимеров
в этих ИЖ.
 Представленные в табл.2 результаты свидетельствуют о том, что исследуемые ИЖ
больше подходят для растворения природных полимеров, чем синтетических. Из
синтетических полимеров в ИЖ можно растворить до высоких концентраций только
поливиниловый спирт. Замена хлорид-аниона на ацетат приводит к значительному
повышению растворяющей способности ионной жидкости по отношению как к
полисахаридам целлюлозе и декстрану, так и к полипептидам фиброину и альбумину.
По совокупности экспериментальных и литературных данных можно заключить, что
растворяющая способность ИЖ на основе 1-бутил-3-метилимидазолия в зависимости
от природы аниона уменьшается в ряду CH3COO- > Cl- > Br- ~ SCN-. Представленные в табл.2 результаты свидетельствуют о том, что исследуемые ИЖ
больше подходят для растворения природных полимеров, чем синтетических. Из
синтетических полимеров в ИЖ можно растворить до высоких концентраций только
поливиниловый спирт. Замена хлорид-аниона на ацетат приводит к значительному
повышению растворяющей способности ионной жидкости по отношению как к
полисахаридам целлюлозе и декстрану, так и к полипептидам фиброину и альбумину.
По совокупности экспериментальных и литературных данных можно заключить, что
растворяющая способность ИЖ на основе 1-бутил-3-метилимидазолия в зависимости
от природы аниона уменьшается в ряду CH3COO- > Cl- > Br- ~ SCN-.
При одинаковых катионах БМИА имеет больший по размеру ацетат-анион и
соответственно меньшую плотность энергии когезии [8]. БМИХ имеет температуру
плавления ~70°С, БМИА является жидкостью при комнатной температуре. Меньшая
степень самоассоциации молекул ИЖ может быть одной из причин более высокой
растворяющей способности БМИА в сравнении с БМИХ. Действительно, повышение
температуры, следствием которого является уменьшение ассоциации молекул
растворителя, приводит к увеличению его растворяющей способности. В работе [17]
показано, что при 100°С в БМИХ можно растворить 4% (масс.) кератина, при 130°С
- 11%.
 Вместе с тем межчастичные взаимодействия в растворе являются суммой, по крайней
мере, трех составляющих. Это взаимодействия полимер - полимер и растворитель -
растворитель, разрушение связей при растворении дает эндотермический вклад в
свободную энергию Гиббса, а также взаимодействие полимер - растворитель, от
характеристик которого зависит конечный эффект растворения. Кроме того, следует
учитывать, что молекула ионного растворителя, в свою очередь, состоит из катиона и аниона, и характеристики их взаимодействия также могут
оказывать существенное влияние на растворяющую способность ИЖ. Для оценки этих
характеристик используют квантово-химические расчеты, их результаты позволяют
определить основные параметры образования молекулярных и ионных комплексов. Как
показано методом ЯМР [19], ионные жидкости не образуют производных целлюлозы,
т.е. переводят ее в раствор по механизму “прямой” сольватации. Таким образом,
энергетические характеристики взаимодействия полимер - растворитель могут быть
использованы для сравнения растворяющей способности различных ионных жидкостей
по отношению к природным полимерам. Вместе с тем межчастичные взаимодействия в растворе являются суммой, по крайней
мере, трех составляющих. Это взаимодействия полимер - полимер и растворитель -
растворитель, разрушение связей при растворении дает эндотермический вклад в
свободную энергию Гиббса, а также взаимодействие полимер - растворитель, от
характеристик которого зависит конечный эффект растворения. Кроме того, следует
учитывать, что молекула ионного растворителя, в свою очередь, состоит из катиона и аниона, и характеристики их взаимодействия также могут
оказывать существенное влияние на растворяющую способность ИЖ. Для оценки этих
характеристик используют квантово-химические расчеты, их результаты позволяют
определить основные параметры образования молекулярных и ионных комплексов. Как
показано методом ЯМР [19], ионные жидкости не образуют производных целлюлозы,
т.е. переводят ее в раствор по механизму “прямой” сольватации. Таким образом,
энергетические характеристики взаимодействия полимер - растворитель могут быть
использованы для сравнения растворяющей способности различных ионных жидкостей
по отношению к природным полимерам.
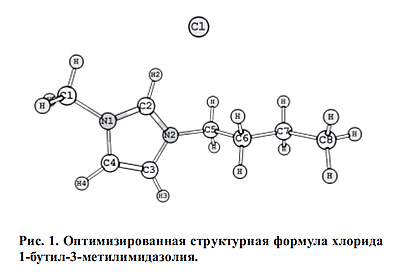
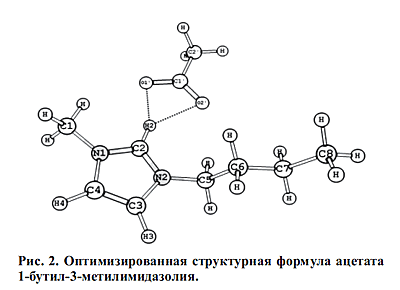
 На рис.1 и 2 приведены оптимизированные методом HF 6-31G [20] структуры
молекулы БМИХ и БМИА. На рис.1 и 2 приведены оптимизированные методом HF 6-31G [20] структуры
молекулы БМИХ и БМИА.
Результаты рентгеноструктурного анализа и квантово-химических расчетов
геометрии хлоридов 1-алкил-3-метилимидазолия позволили установить, что связи
атомов углерода кольца с соседними атомами водорода и атомами углерода боковых
групп, а также анионы Cl находятся практически в плоскости кольца независимо от
длины боковых радикалов катиона и их количества. Длина связей в кольце
практически не меняется при изменении длины и количества боковых алкильных
радикалов. В боковых радикалах валентные углы между углеродными атомами
составляют 107-112 град. Эффективный положительный заряд сосредоточен
преимущественно на атомах водорода Н2, Н3 и Н4 имидазольного кольца (табл.3,
обозначения атомов в соответствии с рис.1 и 2).
Отрицательный заряд ацетат-аниона в БМИА сосредоточен на двух кислородных
атомах 01' и 02'. Квантово-химические расчеты позволили установить, что для
имидазолий-катионов с двумя алкильными радикалами термодинамически наиболее
устойчиво положение аниона вблизи атома водорода Н2, как показано на рис.1 и 2.
Хлорид-анион образует одну, а ацетат-анион - одновременно две связи с протоном
Н2, длина связей составляет(в
 ): ):
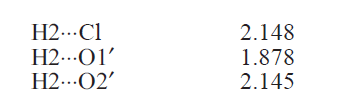
В результате энергия взаимодействия ацетат-аниона с катионом ионной жидкости
оказалась больше, чем для хлорида (-85.4 и -72.2 ккал/моль соответственно).
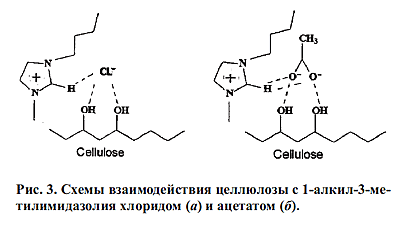
0птимизация потенциальной энергии сольватного комплекса модель целлюлозы -
молекула ИЖ привела к следующей схеме взаимодействия: анион молекулы
растворителя образует с атомами водорода гидроксильных групп целлюлозы
водородные связи (рис.3).
 По результатам расчетов методом HF 6-21G обнаружено, что энергии образования
наиболее устойчивого сольватного комплекса молекула растворителя - целлобиоза
составили около -24 ккал/моль в случае хлорида и -(28-31) ккал/моль в случае
ацетата 1-бутил-3-метилимидазолия. Эти значения существенно превышают энергию
внутримолекулярных связей в кристаллической структуре целлюлозы, которая
согласно [22] составляет 6 ккал/моль. Можно сделать вывод, что отмеченная на
практике более высокая растворяющая способность ацетата
1-бутил-3-метилимидазолия в сравнении с хлоридом того же катиона объясняется
различием в экзотермичности их взаимодействия с гидроксильными группами
целлюлозы. В результате более сильное взаимодействие целлюлозы с ацетатом
1-бутил-3-метилимидазолия обусловливает меньшую вязкость концентрированных
растворов в сравнении с хлоридом того же катиона [18]. По результатам расчетов методом HF 6-21G обнаружено, что энергии образования
наиболее устойчивого сольватного комплекса молекула растворителя - целлобиоза
составили около -24 ккал/моль в случае хлорида и -(28-31) ккал/моль в случае
ацетата 1-бутил-3-метилимидазолия. Эти значения существенно превышают энергию
внутримолекулярных связей в кристаллической структуре целлюлозы, которая
согласно [22] составляет 6 ккал/моль. Можно сделать вывод, что отмеченная на
практике более высокая растворяющая способность ацетата
1-бутил-3-метилимидазолия в сравнении с хлоридом того же катиона объясняется
различием в экзотермичности их взаимодействия с гидроксильными группами
целлюлозы. В результате более сильное взаимодействие целлюлозы с ацетатом
1-бутил-3-метилимидазолия обусловливает меньшую вязкость концентрированных
растворов в сравнении с хлоридом того же катиона [18].
Влияние строения имидазолий-катиона на растворяющую способность ИЖ по отношению
к природным полимерам также пока мало изучено. Имеются сведения о том, что в
1-этил-3-метилимидазолия хлориде растворимость фиброина при 100°С почти вдвое
больше, чем в 1-бутил-3-метилимидазолия хлориде (23.3 и 13.2% соответственно
[15]). Тот же источник сообщает, что в 1-бутил-2,3-диметилимидазолия хлориде
можно получить раствор фиброина концентрацией 8.3%, т.е. при увеличении длины
R1-алкильного радикала или при появлении третьего радикала R3 растворяющая
способность ИЖ по отношению к фиброину уменьшается. Наши исследования показали,
что при дальнейшем увеличении длины радикала эта тенденция подтверждается: в
1-гексил-3-метилимидазолия хлориде (R1 = С6Н13) при 100ºС можно растворить не
более 4% (масс.) фиброина. При анализе реологических характеристик растворов
целлюлозы в ИЖ с разной длиной и количеством радикалов в имидазолий-катионе
также обнаруживается подобная закономерность. По данным [18], вязкость
концентрированных растворов целлюлозы при замене радикала С4Н9 на С2Н5 в
1-алкил-3-метилимидазолия хлориде уменьшается, а при появлении в кольце катиона
третьего радикала R3 возрастает. То же имеет место для концентрированных
растворов целлюлозы в ацетате 1-бутил-3-метилимидазолия.
Строение имидазолий-катиона не менее существенно влияет на энергию
взаимодействия с полимером и соответственно растворяющую способность ИЖ, чем
природа аниона: с увеличением длины или количества алкильных радикалов
растворяющая способность ИЖ по отношению к природным полимерам уменьшается.
Наблюдается [5] и обратная зависимость, при растворении 1-гексена. Можно
предположить, что возрастание гидрофобности ионной жидкости с увеличением
длины алкильного радикала или их количества приводит к уменьшению ее
растворяющей способности по отношению к полярным соединениям (каковыми являются
природные полимеры целлюлоза и фиброин) и к увеличению - по отношению к
неполярным. Вероятно, этим можно объяснить, что целлюлоза, фиброин и кератин не
растворяются в ИЖ с фосфорсодержащими катионами, которые являются гидрофобными
[23].
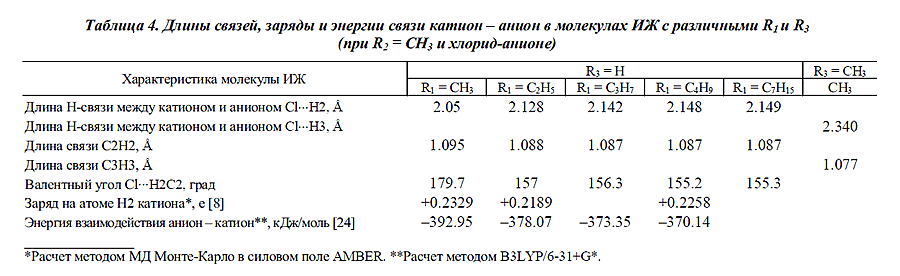
В табл.4 приведены результаты квантово-химических расчетов
некоторых параметров молекул хлоридов 1-алкил-3-метилимидазолия и
1-бутил-2,3-диметилимидазолия. В
катионе последнего на месте атома Н2 находится дополнительный метильный
радикал, поэтому хлорид-анион располагается с противоположной стороны катиона
вблизи атома водорода Н3.
Анализ данных табл.4 позволяет сделать следующие выводы. При увеличении длины
R1-алкильного радикала хлорида 1-алкил-3-метилимидазолия уменьшаются длина связи
С2Н2 (с 1.095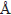 при радикале СН3 до 1.087 при радикале СН3 до 1.087
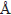 при С6Н6) и валентный угол С1-Н2С2
катиона. Снижается также величина положительного заряда атома Н2, что
обусловливает уменьшение энергии взаимодействия между катионом и анионом и
увеличение расстояния между ними С1---Н2 (соответственно с 2.05 до 2.149 при С6Н6) и валентный угол С1-Н2С2
катиона. Снижается также величина положительного заряда атома Н2, что
обусловливает уменьшение энергии взаимодействия между катионом и анионом и
увеличение расстояния между ними С1---Н2 (соответственно с 2.05 до 2.149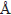 ). Та
же тенденция наблюдается при введении в имидазолий-катион третьего радикала: у
1-бутил-2.3-диметил и- мидазолия хлорида расстояние между анионом С1- и ближайшим
к нему атомом водорода кольца Н3 наибольшее из изученных ИЖ и составляет 2.34 ). Та
же тенденция наблюдается при введении в имидазолий-катион третьего радикала: у
1-бутил-2.3-диметил и- мидазолия хлорида расстояние между анионом С1- и ближайшим
к нему атомом водорода кольца Н3 наибольшее из изученных ИЖ и составляет 2.34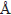 . Сопоставление результатов расчетов с экспериментальными данными о
растворимости природных полимеров в различных ИЖ позволяет проследить тенденцию
возрастания растворяющей способности ИЖ с увеличением энергии связи между
катионом и анионом. С одной стороны, изменение энергии взаимодействия катион -
анион может быть следствием изменения гидрофобности катиона, с другой - может
иметь самостоятельное влияние на растворяющую способность ИЖ. Можно полагать,
что большей растворяющей способностью обладают ИЖ с меньшей склонностью к
диссоциации молекул на ионы. Действительно, чтобы экранировать макроцепи
целлюлозы от межмолекулярного взаимодействия друг с другом, необходимо, чтобы
размер молекулы растворителя был сопоставим с размером глюкозидного звена
[25-27]. Как можно видеть из приведенных выше схем взаимодействия ИЖ с
фрагментом целлюлозы, анионы растворителя играют решающую роль в сольватации,
но при этом необходимо, чтобы находящийся в непосредственной близости объемный
катион создавал стерическое препятствие для восстановления разрушенных
водородных связей сольватируемых макроцепей полимера друг с другом. . Сопоставление результатов расчетов с экспериментальными данными о
растворимости природных полимеров в различных ИЖ позволяет проследить тенденцию
возрастания растворяющей способности ИЖ с увеличением энергии связи между
катионом и анионом. С одной стороны, изменение энергии взаимодействия катион -
анион может быть следствием изменения гидрофобности катиона, с другой - может
иметь самостоятельное влияние на растворяющую способность ИЖ. Можно полагать,
что большей растворяющей способностью обладают ИЖ с меньшей склонностью к
диссоциации молекул на ионы. Действительно, чтобы экранировать макроцепи
целлюлозы от межмолекулярного взаимодействия друг с другом, необходимо, чтобы
размер молекулы растворителя был сопоставим с размером глюкозидного звена
[25-27]. Как можно видеть из приведенных выше схем взаимодействия ИЖ с
фрагментом целлюлозы, анионы растворителя играют решающую роль в сольватации,
но при этом необходимо, чтобы находящийся в непосредственной близости объемный
катион создавал стерическое препятствие для восстановления разрушенных
водородных связей сольватируемых макроцепей полимера друг с другом.
Растворимость природных полимеров в
бинарных смесях на основе ионных жидкостей
Хотя известно, что ионные жидкости смешиваются с водой и органическими
растворителями [4], растворяющая способность бинарных смесей на основе ИЖ по
отношению к природным полимерам до настоящего времени не исследована. Вместе с
тем для снижения вязкости растворов, а также стоимости растворителя
целесообразным может быть введение в ИЖ разбавителей, которые самостоятельно
изучаемые полимеры не растворяют. Поэтому следующей задачей исследования стало
изучение растворимости природных и синтетических полимеров в бинарных смесях на
основе ионных жидкостей. Большинство ИЖ гигроскопичны и легко удерживают воду,
образуя кристаллогидраты. Экспериментально установлено, что растворяющая
способность многих ионных жидкостей, в том числе хлорида
1-бутил-3-ме-тилимидазолия, по отношению к целлюлозе в присутствии воды резко
уменьшается. Объяснить влияние воды на свойства растворителя можно с
привлечением результатов проведенного методом HF 6-31G* квантово-химического
расчета комплексов БМИХ - n молекул воды, где n = 1-4. Значения дипольных
моментов молекулы БМИХ, заряда аниона С1 и перенесенного заряда с молекулы БМИХ
на молекулы воды приведены в табл.5.
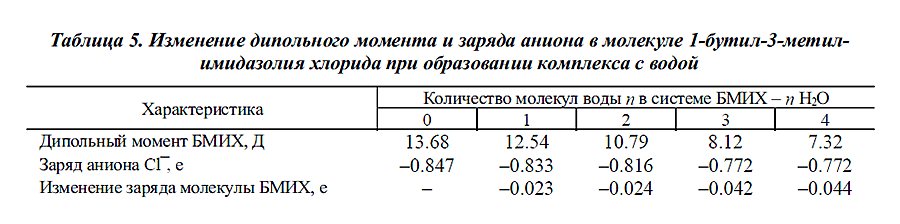
 Как следует из табл.5, добавление воды приводит к уменьшению значения дипольного
момента растворителя, абсолютной величины отрицательного аниона С1 и молекулы БМИХ в целом. Из этого можно заключить, что в присутствии воды уменьшаются
электронодонорные свойства молекулы БМИХ. Кроме того, вода и органические
протонодонорные разбавители являются конкурентами растворяемому полимеру,
поскольку их протоны способны к образованию водородных связей с
электронодонорными центрами ИЖ. Как следует из табл.5, добавление воды приводит к уменьшению значения дипольного
момента растворителя, абсолютной величины отрицательного аниона С1 и молекулы БМИХ в целом. Из этого можно заключить, что в присутствии воды уменьшаются
электронодонорные свойства молекулы БМИХ. Кроме того, вода и органические
протонодонорные разбавители являются конкурентами растворяемому полимеру,
поскольку их протоны способны к образованию водородных связей с
электронодонорными центрами ИЖ.
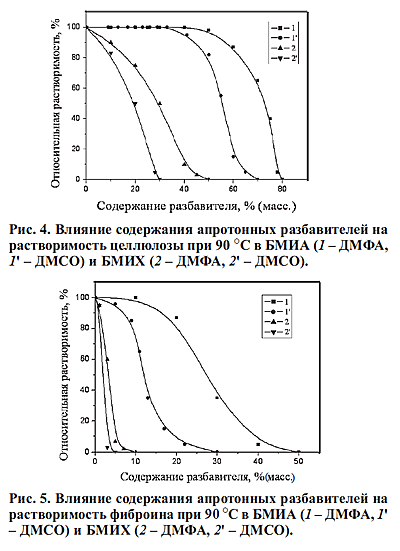
Нами изучены в качестве разбавителей ионных жидкостей апротонные органические
растворители. На рис.4 и 5 приведены зависимости растворяющей способности
бинарных смесей хлорида и ацетата 1-бутил-3-метилимидазолия с
диметилсульфоксидом (ДМСО) и диметилформамидом (ДМФА) по отношению к целлюлозе
и фиброину от концентрации апротонного разбавителя в смеси. Можно видеть, что
исследованные разбавители по разному влияют на растворяющую способность ИЖ.
 Диметилформамид
меньше снижает растворяющую способность как хлорида, так и ацетата
1-бутил-3-метилимидазолия в сравнении с диметилсульфоксидом.
Наибольшей растворяющей способностью обладает бинарная смесь БМИА - ДМФА.
Целлюлоза растворяется в бинарных смесях на основе хлорида 1-бутил-3-метилимидазолия, содержащих до 50% (масс.) ДМФА и до 30% ДМСО; для бинарных смесей ИЖ
с ацетат-анионом эти пределы соответственно 80 и 70%. Фиброин можно растворить
в бинарных смесях на основе хлорида 1-бутил-3-метилимидазолия, содержащих до
10% ДМФА и до 5% ДМСО; для бинарных смесей ИЖ с ацетат-анионом эти пределы
соответственно 50 и 30%. Диметилформамид
меньше снижает растворяющую способность как хлорида, так и ацетата
1-бутил-3-метилимидазолия в сравнении с диметилсульфоксидом.
Наибольшей растворяющей способностью обладает бинарная смесь БМИА - ДМФА.
Целлюлоза растворяется в бинарных смесях на основе хлорида 1-бутил-3-метилимидазолия, содержащих до 50% (масс.) ДМФА и до 30% ДМСО; для бинарных смесей ИЖ
с ацетат-анионом эти пределы соответственно 80 и 70%. Фиброин можно растворить
в бинарных смесях на основе хлорида 1-бутил-3-метилимидазолия, содержащих до
10% ДМФА и до 5% ДМСО; для бинарных смесей ИЖ с ацетат-анионом эти пределы
соответственно 50 и 30%.
Наблюдаемый эффект можно объяснить тем, что диметилформамид меньше конкурирует с основным растворителем за образование
Н-связей с целлюлозой в сравнении с диметилсульфоксидом. Такое утверждение
позволяет сделать сравнение донорных чисел DNSbCl5 исследуемых апротонных
жидкостей, энтальпии смачивания ΔНсм ими целлюлозы, а также результаты
теоретических расчетов энергии водородных связей
ΔEH-cм гидроксильных групп
целлобиозы с ДМСО и ДМФА (табл.6).
По этой причине диметилформамид меньше
снижает растворяющую способность ионных жидкостей.
Проведенное исследование позволяет сделать следующие заключения:
- Ионные жидкости на основе 1-бутил-3-метилимидазолий-катиона не являются
растворителями для большинства синтетических полимеров, но растворяют до
высоких концентраций природные полимеры, характеризующиеся наличием большого
количества Н-связей в надмолекулярной структуре.
- Растворяющая способность ИЖ на основе 1-бутил-3-метилимидазолий-катиона
зависит от природы аниона и величины отрицательного заряда на его электронодонорных центрах: ИЖ с ацетат-анионом лучше растворяют природные
полимеры, чем жидкости с хлорид-анионом.
- Увеличение длины и количества гидрофобных алкильных радикалов имидазолий-катиона приводит к возрастанию гидрофобности ИЖ и сопровождается
уменьшением растворяющей способности по отношению к природным полимерам.
Распределение зарядов в имидазолий-катионе зависит от длины и количества
алкильных радикалов и обусловливает прочность связи катион - анион,
пропорционально которой изменяется растворяющая способность ИЖ.
- Введение протонодонорных разбавителей уменьшает дипольный момент и величину
отрицательного заряда аниона ИЖ, что приводит к потере растворяющей способности
бинарной смеси.
- В исследованные ИЖ можно вводить апротонные разбавители, причем изменение
растворяющей способности бинарной смеси зависит от донорной способности апротонного разбавителя: меньшее снижение растворяющей способности наблюдается для
бинарной смеси, в которой разбавитель имеет меньшее донорное число и слабее
конкурирует с ИЖ за образование водородных связей с полимером.
|
